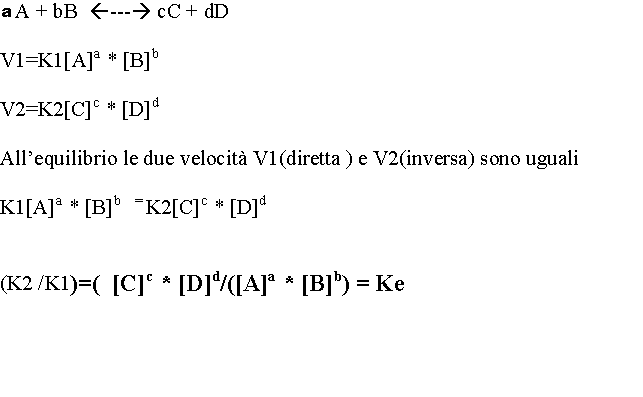
equilibrio chimico dinamico e legge di azione di massa ritorna
In un sistema chimico all'equilibrio,la reazione diretta(1) che trasforma i reagenti in prodotti di reazione e la reazione inversa(2) che trasforma i prodotti di reazione nei reagenti iniziali avvengono con la stessa velocità: V1 = V2 le velocità di reazione ,a parità di altre condizioni,sono proporzionali alle concentrazioni molari delle sostanze reagenti elevate ad un esponente pari al coefficiente stechiometrico:la costante di proporzionalità varia se varia la temperatura consideriamo una reazione generica aA + bB <----> cC + dD oppure reale 3H2 + N2 <-----> 2 NH3 con a,b,c,d coefficienti di reazione A,B reattivi e C,D prodotti di reazione all'equilibrio si avrà
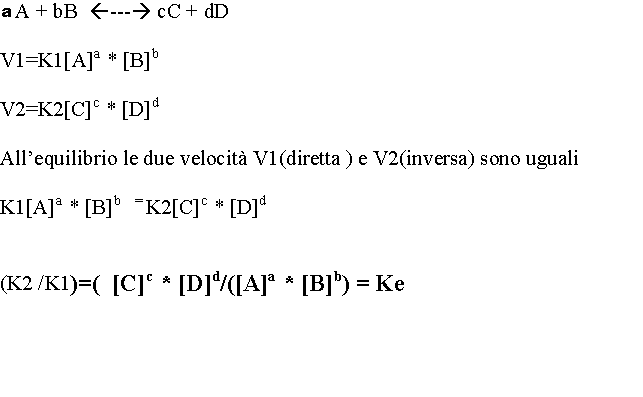
la formula
esprime la legge di azione di massa o dell'equilibrio dinamico :
in un sistema chimico all'equilibrio risulta costante (Ke) il
rapporto tra il prodotto
delle concentrazioni molari[] dei prodotti di reazione,elevate al
loro coefficiente
stechiometrico e il prodotto delle concentrazioni molari dei
reattivi pure elevate
ai loro coefficienti stechiometrici:tale valore rimane costante
se non varia la temperatura
un valore di Ke=1 indica una
equivalenza tra reagenti e prodotti all'equilibrio
un valore di Ke>1 indica una prevalenza dei prodotti sui
reagenti
un valore di Ke<1 indica una prevalenza dei reagenti sui
prodotti
una perturbazione indotta
sul sistema in stato di equilibrio comporta una
risposta da parte del sistema che tende a neutralizzare l'effetto
della perturbazione stessa
perturbazione dovute a variazioni di concentrazioni,pressione,temperatura
principio
di Le Chatelier
1-un aumento di reagenti favorisce
la loro trasformazione in prodotti per
mantenere costante il rapporto(aumenta numeratore e anche
denominatore)--->
2-una asportazione di reagenti favorisce la reazione inversa che
trasforma i
prodotti in reagenti <----
3-un aumento di prodotti favorisce la razione inversa che li
trasforma in reagenti <---
4-un asportazione di prodotti favorisce la reazione diretta che
ne genera altri --->
1-un aumento di
pressione favorisce la reazione che avviene con diminuzione di
volume(indicato dal diminuire dei coefficienti)
2-una diminuzione di pressione favorisce la reazione che avviene
con aumento
di volume(indicato dall'aumento dei coefficienti)
1-una aggiunta di
calore favorisce la reazione endotermica
2-una asportazione di calore favorisce la reazione esotermica
H2 + Cl2
<------> 2HCl ...se aggiungo H2 favorisco ---->
H2 + Cl2 <------> 2HCl ...se asporto H2 favorisco <-----
H2 + Cl2 <------> 2HCl ...se aggiungo HCl favorisco <---
H2 + Cl2 <------> 2HCl ...se asporto HCl favorisco ---->
3H2 + N2 <-----> 2NH3 se
aumenta la pressione favorisco ----->
3H2 + N2 <-----> 2NH3 se diminuisce la pressione favorisco
<------
3H2 + N2
<-----> 2NH3 + Calore se asporto calore favorisco ----->
3H2 + N2 <-----> 2NH3 se aggiungo calore favorisco
<------